
Φαρμακογονιδιωματική & εξατομικευμένη Ιατρική
1 Απριλίου 2020
5 λεπτά ανάγνωσης
872 λέξεις
Ενημερώθηκε 7 Νοε 2022
 Η Φαρμακογονιδιωματική και η εξατομικευμένη Ιατρική αποσκοπούν στη χρήση του γενετικού προφίλ των ασθενών και τον συσχετισμό τους με τις διαφορές στην ανταπόκρισή τους στη φαρμακευτική αγωγή, τόσο σε ό,τι αφορά την τοξικότητα και την εμφάνιση παρενεργειών όσο και στην αποτελεσματικότητα της θεραπείας και στη γενετική αιτιολογία γενετικών νοσημάτων, αντίστοιχα.
Η Φαρμακογονιδιωματική και η εξατομικευμένη Ιατρική αποσκοπούν στη χρήση του γενετικού προφίλ των ασθενών και τον συσχετισμό τους με τις διαφορές στην ανταπόκρισή τους στη φαρμακευτική αγωγή, τόσο σε ό,τι αφορά την τοξικότητα και την εμφάνιση παρενεργειών όσο και στην αποτελεσματικότητα της θεραπείας και στη γενετική αιτιολογία γενετικών νοσημάτων, αντίστοιχα.
Σήμερα είναι γνωστό ότι πολλά από τα γονίδια που συμμετέχουν στο μεταβολισμό των φαρμάκων εμφανίζουν γενετικές αλλαγές, οι οποίες με τη σειρά τους έχουν μεγάλο αντίκτυπο στην ανταπόκριση των ασθενών σε ευρέως συνταγογραφούμενα φάρμακα.
Αν και τα θεμέλια της Φαρμακογονιδιωματικής ετέθησαν από τον F. Vogel στα τέλη της δεκαετίας του 1950, ο Ιπποκράτης από την αρχαιότητα κιόλας είχε επισημάνει ότι «…είναι σημαντικότερο να γνωρίζει κανείς τι είδους άνθρωπος πάσχει από κάποια ασθένεια, παρά να γνωρίζει κανείς από τι είδους ασθένεια πάσχει κάποιος άνθρωπος», θέτοντας έτσι την εννοιολογική βάση της εξατομικευμένης Ιατρικής [personalized (individualized) Μedicine].
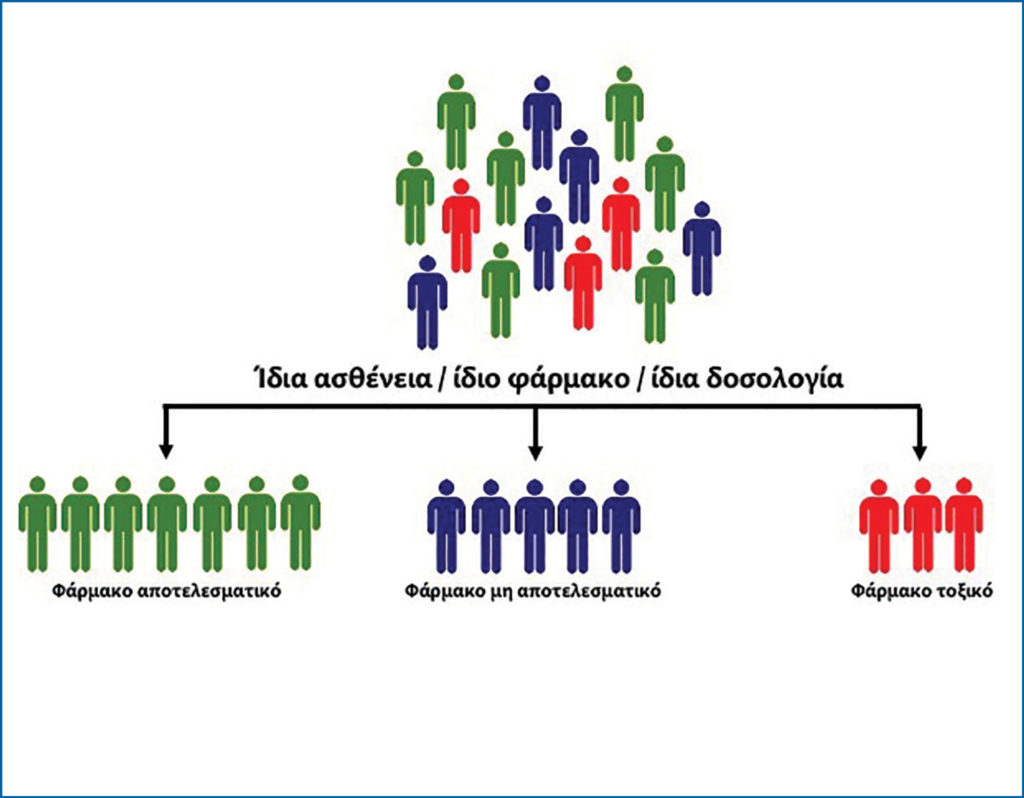
Η Φαρμακογονιδιωματική επιτρέπει να προβλεφθούν ακραίες φαινοτυπικές διαφορές στη φαρμακοκινητική ή τη φαρμακοδυναμική ενός φαρμάκου. Με άλλα λόγια, σε μία ομάδα ασθενών, οι οποίοι έχουν την ίδια διάγνωση και λαμβάνουν την ίδια φαρμακευτική αγωγή (ίδιο σκεύασμα και δοσολογία), η θεραπεία θα είναι αποτελεσματική μόνο για μια ομάδα ασθενών. Αντίθετα, σε μια άλλη ομάδα ασθενών, η θεραπευτική αγωγή δεν θα είναι επωφελής, ενώ, τέλος, σε μια τρίτη ομάδα ασθενών, η θεραπευτική αγωγή θα προκαλέσει παρενέργειες.
Στις μέρες μας, η Φαρμακογονιδιωματική βρίσκει εφαρμογή σε πάνω από 230 από τα συχνότερα συνταγογραφούμενα φάρμακα στην κλινική πράξη και σε διάφορες ιατρικές ειδικότητες, όπως Ογκολογία, Καρδιολογία, Ψυχιατρική, για την ανταπόκριση σε ανοσοκατασταλτικά φάρμακα για τις μεταμοσχεύσεις, και άλλες. Έτσι, πολλές γενετικές παραλλαγές σε διάφορα γονίδια έχουν βρεθεί να σχετίζονται με την καλύτερη ανταπόκριση των ογκολογικών ασθενών σε μια σειρά φαρμακευτικών ουσιών, όπως η ταμοξιφαίνη και το γονίδιο CYP2D6 για τη θεραπεία του καρκίνου του μαστού, η ιρινοτεκάνη και το γονίδιο UGT1A1 για την αποφυγή παρενεργειών στη θεραπεία ασθενών με καρκίνο του εντέρου ή η 6-μερκαπτοπουρίνη (6-ΜΡ) και το γονίδιο ΤΡΜΤ για τη θεραπεία ασθενών με αιματολογικούς καρκίνους. Επιπρόσθετα, η Φαρμακογονιδιωματική εφαρμόζεται για την εξατομίκευση της θεραπείας καρδιολογικών ασθενών και συγκεκριμένα δυο ευρέως χρησιμοποιούμενων αντιπηκτικών, όπως τα κουμαρινικά και η κλοπιδογρέλη, τα οποία χρησιμοποιούνται για τη θεραπεία καρδιαγγειακών παθήσεων.
Επίσης, πρόσφατες μελέτες εμπλέκουν γονίδια που κωδικοποιούν παράγοντες οι οποίοι διαδραματίζουν ρόλο στο μεταβολισμό ψυχοτρόπων φαρμάκων στην εξατομίκευση της θεραπείας με αντιψυχωσικά ή αντικαταθλιπτικά φάρμακα.
Η Φαρμακογονιδιωματική στην Ελλάδα
Η Φαρμακογονιδιωματική έχει ήδη αρχίσει να εφαρμόζεται εδώ και χρόνια στην κλινική πράξη στη χώρα μας. Συγκεκριμένα, ογκολογικοί και καρδιολογικοί ασθενείς ήδη επωφελούνται από τη διενέργεια φαρμακογονιδιωματικών αναλύσεων για την εξατομίκευση της φαρμακευτικής τους αγωγής, ενώ από το 2017 διενεργείται στο Εργαστήριο Φαρμακογονιδιωματικής και Εξατομικευμένης Θεραπείας του Τμήματος Φαρμακευτικής του Πανεπιστημίου Πατρών η μεγαλύτερη, παγκοσμίως, προοπτική φαρμακογονιδιωματική κλινική μελέτη, στην οποία περιλαμβάνονται ήδη πάνω από 1.200 ασθενείς που πάσχουν από σχιζοφρένεια, κατάθλιψη και διπολική διαταραχή. Επίσης, το παραπάνω εργαστήριο, το οποίο είναι διεθνώς γνωστό και πρωτοπόρο στη χώρα μας στο πεδίο αυτό, αλλά και άλλα εργαστήρια ανά την επικράτεια συμμετέχουν σε ερευνητικές μελέτες στο πεδίο αυτό, σε συνεργασία με ακαδημαϊκά ιδρύματα στην αλλοδαπή με πολύ ενθαρρυντικά αποτελέσματα.
Επιπρόσθετα, το γνωστικό αντικείμενο της Φαρμακογονιδιωματικής ενσωματώνεται ολοένα και περισσότερο στα προγράμματα προπτυχιακών και μεταπτυχιακών σπουδών των βιοϊατρικών σχολών της χώρας για την εκπαίδευση των νέων βιοεπιστημόνων, ενώ παράλληλα διεθνή και εθνικά συνέδρια και ημερίδες έχουν ήδη διοργανωθεί στη χώρα μας με αυτή τη θεματολογία την τελευταία δεκαετία.
Οι δραστηριότητες αυτές αναμένεται να συμβάλουν στην υιοθέτηση της Φαρμακογονιδιωματικής ολοένα και περισσότερο στη σύγχρονη ιατρική πράξη στη χώρα μας.

Προοπτικές και ηθικά διλήμματα
Η Φαρμακογονιδιωματική αναμένεται να διαλευκάνει ολοένα και περισσότερο την αιτιολογία των διαφορών στη φαρμακευτική ανταπόκριση και θα βελτιώσει την ασφάλεια και την αποτελεσματικότητα της φαρμακευτικής θεραπείας σε μεμονωμένους ασθενείς, γεγονός που θα μειώσει και το συνολικό κόστος της ιατροφαρμακευτικής περίθαλψης.
Μέσω διάφορων πρωτοβουλιών, ο Οργανισμός Τροφίμων και Φαρμάκων των ΗΠΑ (FDA), αλλά και η Ευρωπαϊκή Υηρεσία Φαρμάκων (ΕΜΑ) υποστηρίζει την πορεία προς την εξατομικευμένη θεραπεία και ελπίζει ότι οι φαρμακευτικές εταιρείες θα χρησιμοποιήσουν τη φαρμακογονιδιωματική πληροφορία στην αξιολόγηση των διαφορών μεταξύ των ασθενών, ενώ οι πληροφορίες αυτές συμπεριλαμβάνονται πλέον σε διαρκώς μεγαλύτερο βαθμό στα φύλλα οδηγιών των φαρμακευτικών προϊόντων, πριν ή και μετά την έγκριση της διάθεσης του φαρμάκου στην αγορά.
Εξαιρετικά σημαντική είναι επίσης η διενέργεια οικονομικών μελετών για τη διακρίβωση της σχέσης κόστους και αποτελεσματικότητας των φαρμακογονιδιωματικών αναλύσεων, δεδομένα τα οποία θα χρησιμοποιηθούν από το κράτος για την κοστολόγηση και τελικά την αποζημίωση των υπηρεσιών αυτών από τα ασφαλιστικά ταμεία και εταιρείες, όπως συμβαίνει όλο και σε περισσότερες χώρες του εξωτερικού, μιας και οι υπηρεσίες αυτές, όπως προαναφέρθηκε, δεν βελτιώνουν μόνο την ποιότητα ζωής των ασθενών, αλλά και με τη μείωση των παρενεργειών των φαρμάκων, μειώνουν σημαντικά και την κρατική ιατροφαρμακευτική δαπάνη.
Παράλληλα, είναι ιδιαίτερα σημαντικό να τεθεί από την Πολιτεία ένα ρυθμιστικό πλαίσιο για την παροχή υπηρεσιών εξατομικευμένης Ιατρικής και γενετικών αναλύσεων για την προστασία των προσωπικών δεδομένων των ασθενών και την προάσπισή τους από γενετικές αναλύσεις, που παρέχονται από ορισμένα, ιδιωτικά κυρίως, γενετικά εργαστήρια και οι οποίες στερούνται επιστημονικής βάσης, παραπλανώντας έτσι το κοινό και τους ασθενείς.
Συμπερασματικά, το νέο αυτό πεδίο της σύγχρονης Ιατρικής αποτελεί μια πολύ ενδιαφέρουσα ευκαιρία για την εργαστηριακή Ιατρική να πλησιάσει στο στόχο της εξατομικευμένης φαρμακοθεραπείας, για τη βελτίωση της ποιότητας ζωής των ασθενών και της παρεχόμενης ιατροφαρμακευτικής φροντίδας, αλλά και τη μείωση του κόστους της ιατροφαρμακευτικής δαπάνης.
Περισσότερα άρθρα από την κατηγορία: Υγεία
Ανακαλύψτε περισσότερα άρθρα που μπορεί να σας ενδιαφέρουν